双硫死亡 | 发现的细胞 “新” 型死亡方式-MedChemExpress
- 上海皓元生物医药科技有限公司2023年4月18日 9:15 点击:2087
关于细胞的程序性死亡的相关研究一直是生命科学的热门领域,无论是持续火热的"铁死亡" (推文:铁死亡是什么,如何检测?您要的 “一文通” 来了)。还是正在生信领域大方异彩的 “铜死亡” (推文:空降 "热搜" 铜死亡丨解锁细胞死亡新方式),都涉及到 "离子转运"。在转运过程中,溶质载体 (Solute Carriers, SLC) 转运蛋白家族作为重要的膜转运蛋白家族,它们对葡萄糖、氨基酸和金属离子的转运有着重要的影响 (图 1)[1]。
图 1. SLC 蛋白家族对不同离子以及氨基酸等转运[1]
SLC7A11----死亡调控途径中的双刃剑
SLC 家族成员 SLC7A11 转运蛋白在维持细胞内谷胱甘肽水平和保护细胞免受氧化应激诱导的细胞死亡方面具有重要作用,具有公认的促生存作用[3]。但有研究表明,胶质母细胞瘤细胞在葡萄糖剥夺条件下,通过 System Xc- (其中 SLC7A11 为催化亚基) 摄取胱氨酸会迅速诱导 NADPH 耗竭、活性氧物质积累和细胞死亡。
2020 年甘波谊团队在 Nature Cell Biology 发表的文章也表明,葡萄糖饥饿条件下,高 SLC7A11 表达反而促进细胞死亡,SLC7A11 就像是调节细胞氧化还原平衡和细胞死亡/存活方面的双刃剑[4]。
 图 2. 葡萄糖饥饿条件下,高 SLC7A11 表达反而促进细胞死亡[5]
图 2. 葡萄糖饥饿条件下,高 SLC7A11 表达反而促进细胞死亡[5]
SLC7A11 和 SLC3A2 组成的胱氨酸/谷氨酸逆向转运蛋白 System Xc -,将胞内谷氨酸转出以 1:1 的比例来换取胞外的胱氨酸 (Cys2)
■ SLC7A11 高表达为何会 “促” 死亡?
这是因为胱氨酸是种不溶性氨基酸,为了防止细胞内高度不溶性胱氨酸的毒性积聚, SLC7A11high 细胞需要迅速将胱氨酸还原为半胱氨酸,而这个过程需要从葡萄糖-戊糖磷酸途径 (PPP) 获得大量 NADPH,这会对细胞NADPH 库会造成大量消耗,并使此类细胞产生葡萄糖和戊糖磷酸途径 (PPP) 依赖性 (如图 2) [4,5]。因此,当葡萄糖供应限制,氧化还原力不足, SLC7A11high 细胞内的胱氨酸或其他二硫化物分子的异常积累,诱发二硫化物应激触发细胞死亡。 今年 2 月,甘波谊团队发表的 Actin cytoskeleton vulnerability to disulfide stress mediates disulfidptosis 一文更加详细阐明了这一死亡机制,研究表明肌动蛋白细胞骨架对二硫化应激的敏感性介导了双硫死亡 (disulfidptosis),并提出了在癌症治疗中靶向二硫化的治疗策略。
SLC7A11-high 细胞的独特细胞死亡方式
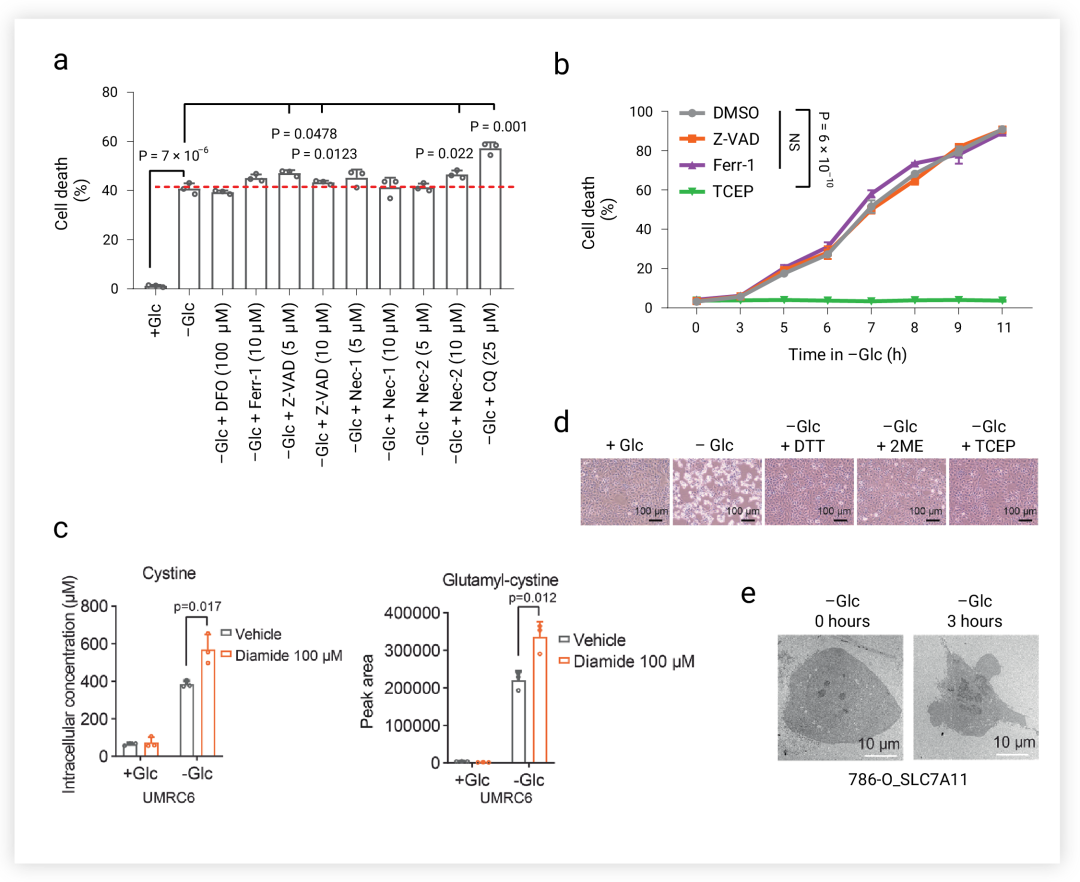
双硫死亡是一种不同于铁死亡,凋亡等的新型死亡方式,在 SLC7A11high 细胞中,铁死亡,凋亡,细胞坏死以及自噬抑制剂都不能挽救葡萄糖饥饿诱导的细胞死亡 (图 3a-b), 但二硫应激的还原剂,如二硫苏糖醇 (DTT)、β-巯基乙醇 (2ME) 和 TCEP 可以完全抑制 SLC7A11high 细胞中葡萄糖饥饿诱导的细胞死亡 (图 3d)。此外,硫醇氧化剂(二胺和马来酸二乙酯)促进 SLC7A11high 细胞在葡萄糖饥饿下的细胞死亡,并导致细胞内二硫分子的急剧积累(如胱氨酸和谷氨酰胱氨酸,经二胺处理后进一步增加) (图 3c)。透射电镜分析显示,在葡萄糖饥饿导致 SLC7A11high 细胞种胱氨酸在细胞质中积聚 (图 3e)。以上结果表明二硫胁迫引起的细胞死亡,与铁死亡,细胞凋亡等都不同,那么其特征到底是什么?
图 3. 葡萄糖饥饿条件下的细胞死亡方式[5]
a. SLC7A11-high 细胞的用 DFO, Fer-1, Z-VAD, Nec-1, Nec-2 和 CQ 处理后的细胞死亡情况。b. 过表达 SLC7A11 的细胞在无葡萄糖培养基中培养中用 Z-VAD, Fer-1 和 TCEP 处理指定时间。c. UMRC6 细胞在含或不含 DTT, 2ME 或 TCEP的培养基中培养。d. UMRC6 细胞内胱氨酸和谷氨酰胱氨酸的积累。e. UMRC6 细胞的典型透射电镜图像。