3D肿瘤球培养解决方案
- 爱必信(上海)生物科技有限公司2024年1月19日 10:13 点击:300
概述:
生命诞生于3D环境,所以传统的2D细胞培养方法,虽然可以保证细胞的生长和对外界刺激产生生理反应,但是和实际生活环境的巨大差异会导致大部分生理功能受限。比如,2D培养环境下的细胞间的相互作用是XY轴的,只是细胞层之间的作用,缺乏Z轴方向的影响,这样就没有养料、氧气和外界刺激物(如:药物处理)的梯度渗透作用。而3D培养环境下细胞可以变成细胞球,从而可以体现出Z轴细胞之间的力作用和各种物质的渗透梯度,和体内的差异相较2D细胞层会大大缩小,从而提高体外细胞实验的准确性。利用体外培养的肿瘤细胞来高通量的筛选新的有效的药物对于挽救癌症病人非常重要。
本期小爱带大家学习肿瘤球培养过程:以乳腺癌细胞MDA-MB-231和MCF-7为例制备3D多细胞肿瘤球并采用倒置显微镜、激光共聚焦显微镜和环境扫描电镜对其进行详细表征。
实验步骤:
一、实验前准备工作
1、提前24h取12mL DMEM(abs9483)和RPMI 1640(abs9484)完全培养基(含10%FBS(abs972),下同)于50mL离心管内,置于4℃冰箱中预冷;
2、将分装好的Matrigel基质胶(abs9490)提前24h从-20℃放入4℃,使其融化成液体状态;
3、将无菌的1mL移液器枪头放入无菌50mL离心管内,置-20℃冰箱预冷。
二、琼脂糖包被96孔板
1、准确量取6mL RPMI 1640培养基(或DMEM培养基)于2个10mL的注射玻璃瓶内,加入90mg琼脂糖(abs44056213),盖塞后放入80℃的水浴锅内加热溶解30min;
2、加热结束后,将注射瓶放入灭菌锅内,115℃灭菌30min;
3、灭菌完成后,迅速取出注射瓶放入超净台内。将注射瓶内的琼脂糖溶液倒入无菌的加样槽中,用多通道移液器以每孔60μL的量加入96孔板内。
注意:由于琼脂糖溶液在室温时会凝固,因此从灭菌锅内取出琼脂糖溶液后一定要快速转移至超净台内并迅速加入至96孔板中。
此外,为保证加样时琼脂糖不冷却,需要同时灭菌加样槽和100μL的移液器枪头。
4、加入完成后,96孔板要保持水平约30min使孔内的琼脂糖凝固。
三、配置含Matrigel基质胶细胞悬液
1、取对数生长期的MDA-MB-231细胞(或MCF-7细胞),胰蛋白酶(abs47014938)消化后进行细胞计数,用RPMI 1640完全培养基(或DMEM完全培养基)将细胞悬液浓度调整至2.0×105cells/mL,备用;
2、将盛满碎冰的烧杯喷完酒精后放入超净台内,将RPMI 1640完全培养基以及解冻的Matrigel基质胶从冰箱内取出置于冰上。
注意:由于Matrigel基质胶在室温下溶液凝固,因此在操作过程中一定要保持低温。
3、将预冷的移液器枪头取出放置于超净台内。根据计算量(2.5%,v/v)用移液器将300μL Matrigel基质胶加入到12mL RPMI 1640完全培养基内,迅速混匀。
注意:由于Matrigel基质胶在室温下溶液凝固,因此使用的移液器枪头也需要预冷。
4、加入步骤1中的细胞悬液(约600μL),使细胞浓度为10000cells/mL,迅速混匀,备用;
四、将细胞悬液铺入琼脂糖包被的96孔板
1、将上述步骤4中配置好的含有Matrigel基质胶的细胞悬液放入加样槽内,用多通道移液器吸取200μL加入到包被琼脂糖的96孔板内;
2、采用微孔板离心机(abs72035)进行离心,离心条件为4℃,1000×g,10min;
注意:离心96孔板时为保持无菌,将96孔板的周围用封口膜封住。
3、离心完成后,取出96孔板,摘下封口膜,喷洒酒精后放入培养箱内培养。整个培养流程如图1所示;
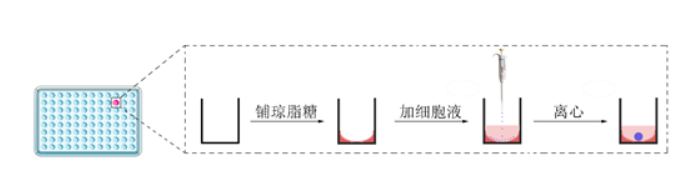
图1
4、在培养的第3、5和7天,更换孔内的100μL培养基并采用倒置显微镜观察肿瘤球的形态;
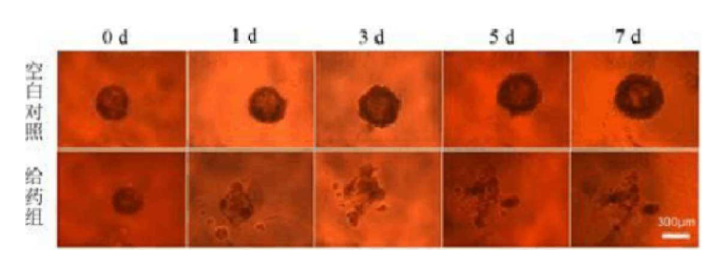
图2
5、若要采用3D多细胞肿瘤球进行药物试验,在培养7天后,用移液器取出孔内的100μL培养基,加入100μL给药溶液,然后置于培养箱内培养并定期采用倒置显微镜观察肿瘤球的生长状况(图2)。
五、3D多细胞肿瘤球的表征
1、倒置显微镜观察3D多细胞肿瘤球形态:直接将96孔板置于倒置显微镜下观察即可;
2、激光共聚焦显微镜观察:用移液器小心取出孔内的肿瘤球,用PBS清洗3遍后,采用4%多聚甲醛(abs9179)固定,并用Hoechst 33258(abs47047617)对细胞核进行染色,PBS清洗3遍后在激光共聚焦显微镜下观察(图3)。

图3
3、环境扫描电镜观察:用移液器小心取出孔内的肿瘤球,用PBS(abs962)清洗3遍后,固定干燥后进行环境扫描电镜观察(图4)。
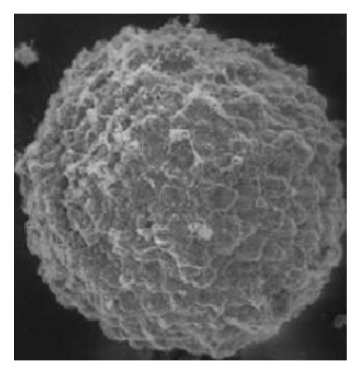
图4
常见问题:
在实践中,我们常常面临细胞无法成球状的问题。下面我们探讨3D细胞培养中细胞不能成球状的原因,以及针对这些问题的解决方法。
一、细胞类型和特性:
细胞的类型和特性是影响其在3D环境中形成球状结构的关键因素之一。不同类型的细胞具有不同的自组织和黏附性能,可能更适合形成其他类型的3D结构,如片状、管状等。
解决方法:在进行3D培养实验之前,必须仔细选择适合自组织的细胞类型。对于不易形成球状结构的细胞,可以尝试使用诱导因子或基因调控方法来促进其自组织能力。
二、细胞外基质 (ECM) 缺乏或不适当:
细胞成球状通常需要适当的细胞外基质支持。如果培养基中的ECM成分不足或不适当,细胞可能无法形成球状。
解决方法:合理设计培养基中的ECM成分,确保细胞有足够的支持来形成球状结构。此外,可以考虑添加外源性ECM支持物质,如适当的基质蛋白、生物活性的材料等。
三、细胞密度不足:
细胞成球状可能需要足够的细胞密度来支持细胞间的相互作用和自组织。如果细胞密度过低,可能会影响球状结构的形成
解决方法:优化细胞接种密度,确保足够的细胞数参与自组织过程。
四、培养条件不适当:
培养条件如培养基成分、温度、氧气浓度等可能会影响细胞成球状的能力。不适当的培养条件可能阻碍了细胞的自组织能力。
解决方法:通过优化培养条件,创造一个更有利于细胞自组织的环境,例如调整培养基成分、温度和气体浓度。
今天讲解就到这了,大家如有3D肿瘤球或类器官问题,欢迎入群交流哦!

注:本文部分知识及图片采纳于网络,如有侵权,可联系删除。

联系邮箱:kefu@labbase.net
版权与免责声明
- 凡本网注明“来源:来宝网”的所有作品,版权均属于来宝网,转载请必须注明来宝网, //www.next-search.com,违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。