基因编辑技术 CRISPR/Cas9,“魔剪”一文通~ | MedChemExpress
- 上海皓元生物医药科技有限公司2023年3月10日 9:04 点击:647
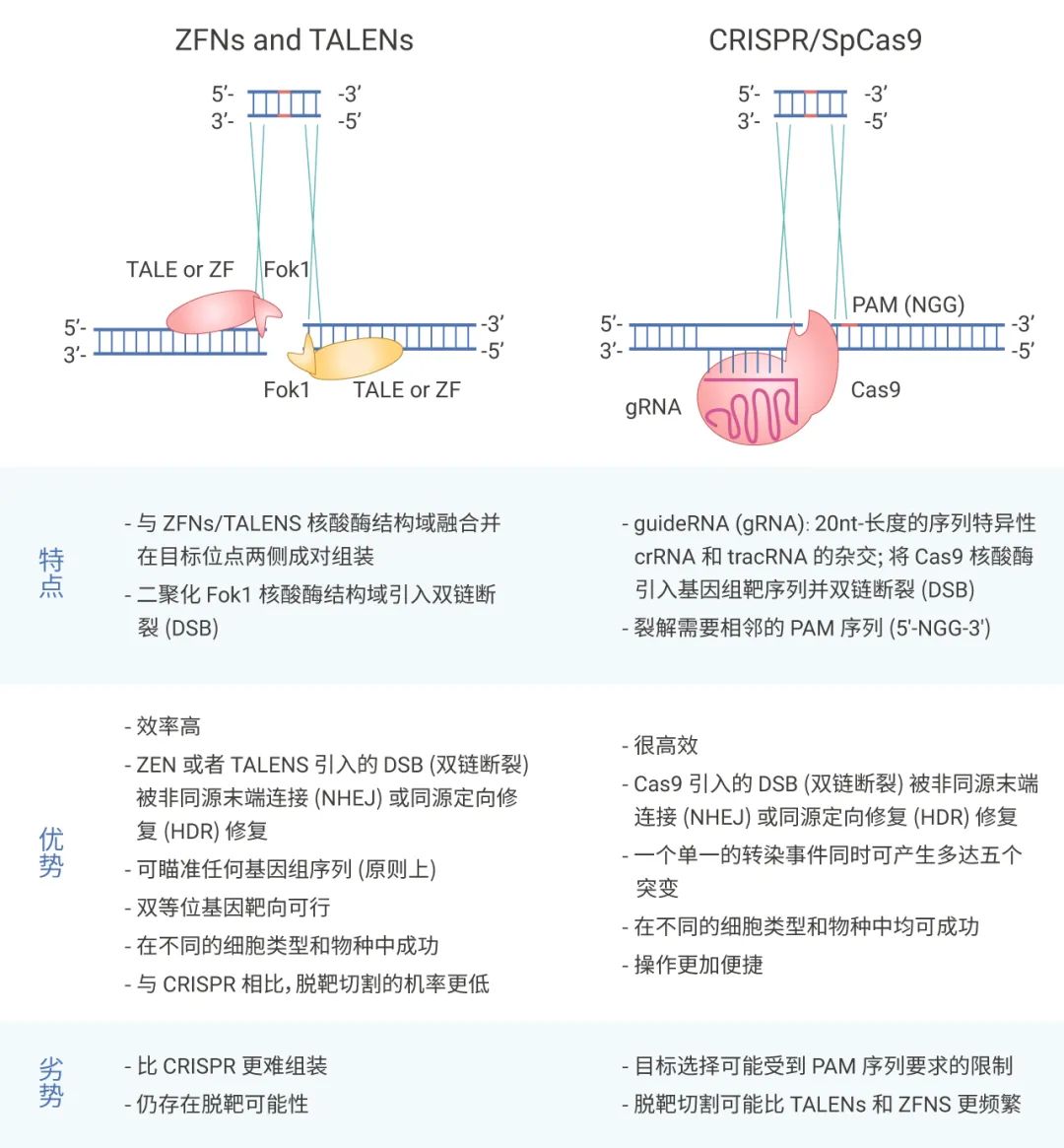
图 1. 不同基因编辑手段的对比
2020 年,两位女性科学家 Emmanuelle Charpentier 和 Jennifer A. Doudna 因发现 CRISPR/Cas9 基因剪刀,而获得 2020 年诺贝尔化学奖。
CRISPR/Cas 系统由一小段 RNA 和一种高效的 DNA 切割酶 (Cas 核酸酶) 组成的系统,该技术不像 TALENs 技术和 ZFNs 技术是依赖于蛋白与靶基因之间的识别,而是由 sgRNA 和靶基因之间形成复合物,从而完成特定基因序列的编辑。
CRISPR/Cas9 技术切割效率相对较高且操作简单,并且可以同时进行多位点的编辑。总之,三种不同的基因编辑技术都有其各自的特点。今天小 M 的“重头戏”,CRISPR/Cas9。
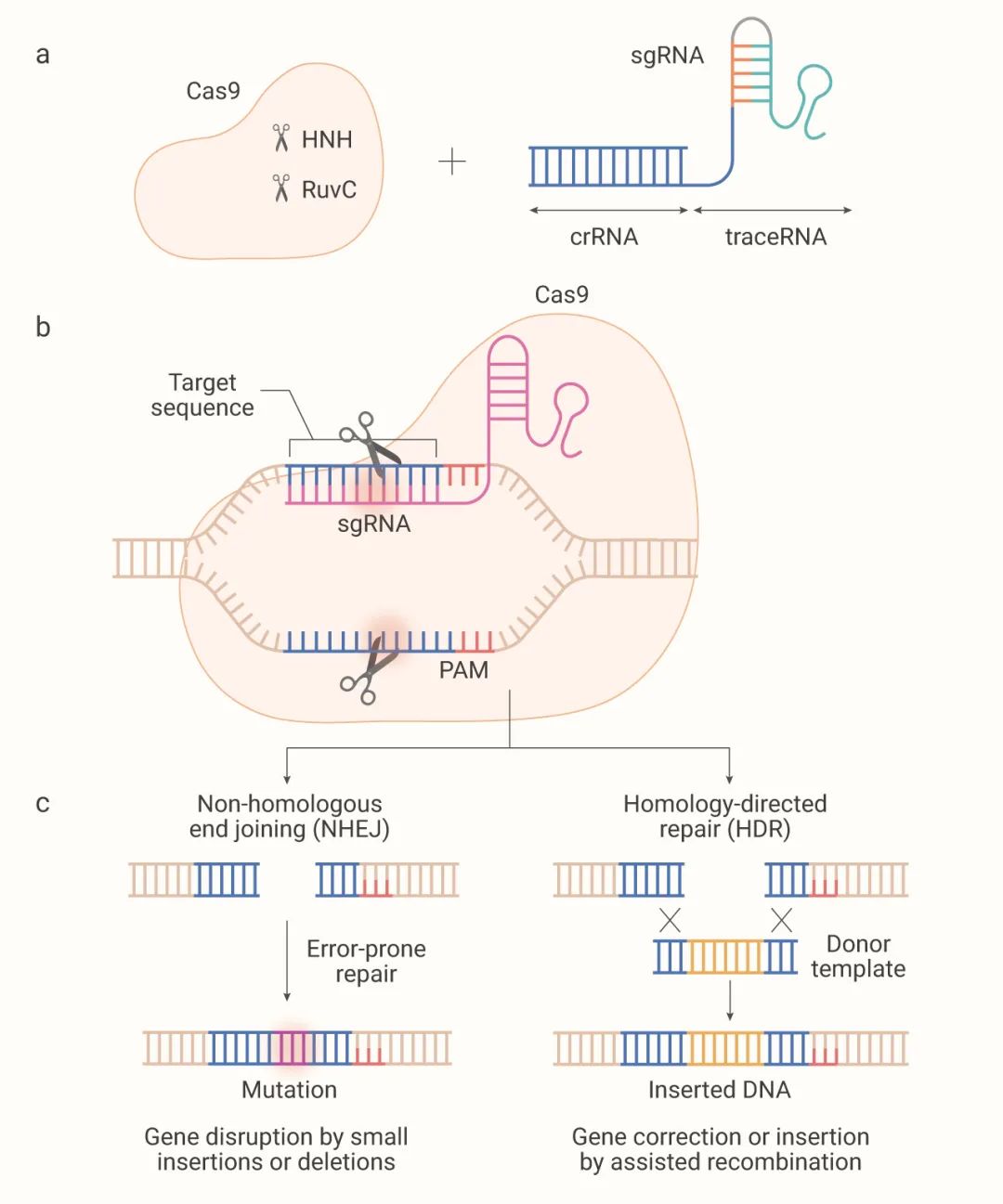
Cas9 蛋白包含两个核酸酶结构域:切割非互补 DNA 链的 RuvC 结构域和切割互补 DNA 链的 HNH 结构域 (如图 2a)。
噬菌体等外源 DNA 入侵时,CAS 蛋白复合物通常识别 3' 端含 NGG 的前间隔序列邻近基序 (PAM) 区域。然后,侵入的噬菌体或质粒释放的短 DNA 片段(称为 Protospacer),插入宿主 CRISPR 位点中 (由重复序列隔开)。
CRISPR 序列转录,形成前体 CRISPR RNA (pre-crRNA)。Cas9 及 RNase III 在 tracrRNA 与 pre-crRNA 上的重复序列配对形成双链 RNA 的条件下,对 pre-crRNA 进行剪切,形成成熟的 tracrRNA-crRNA 双链 RNA (即 sgRNA)。Cas9 核酸酶和 sgRNA 形成 Cas9 核糖核蛋白 (RNP)。
当外源 DNA 再次进入细胞时,Cas9 蛋白携带sgRNA,去识别外源 DNA 的 Protospacer (前间隔序列),并与之结合,通过 Cas9 解旋酶和核酸酶对靶基因进行剪切。造成靶基因 DNA 的双链断裂 (DSB),从而达到干扰靶基因表达的目的,在修复断裂同时引入基因敲除或敲入。
图 2. 通过非同源末端连接 (NHEJ) 或同源定向修复 (HDR) 内源性修复双链 DNA 断裂[2]
■ 小分子激活剂控制 Cas9 活性的策略
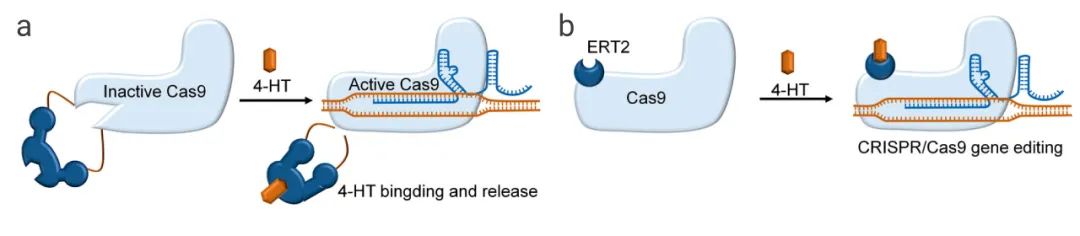
可通过添加小分子来控制 Cas9 的构象变化,来实现对 Cas9 蛋白活性的时空控制。
案例 1:当内含肽插入 Cas9 蛋白的不同位点,Cas9 核酸酶失活;添加 4-HT (4-hydroxytamoxifen),通过构象变化和自切割反应去除内含肽,可重新激活 Cas9 蛋白(图 3a)。根据内含肽的插入位点,Cas9 的激活效率 3 倍到 10 倍不等,与野生型 Cas9 相比,这种调控策略可增加开/脱靶效应比率。
图 3. 小分子激活剂控制 Cas9 活性的策略[9]
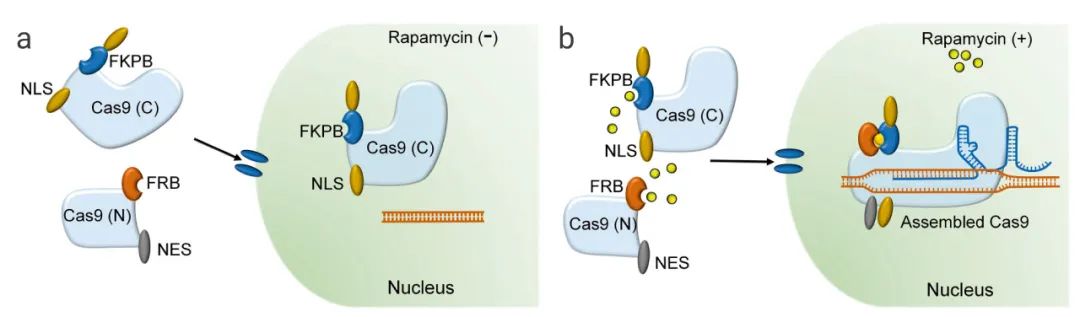
案例 2:基于化学诱导的 Cas9 蛋白分裂片段的二聚化。Zetsche 等人设计了不同的分裂位点 (Arg535 和 Glu573) 生成分裂 Cas9 (split-Cas9) 蛋白,同时产生 C 端和 N 端Cas9 片段 (可分别与 FK506 结合蛋白 (FKBP) 和 FKBP 雷帕霉素结合结构域 (FRB) 结合)。这种方法通过雷帕霉素诱导的异源二聚作用实现了 split-Cas9 的条件重构和激活。
■ 小分子抑制剂控制 Cas9 活性的策略
由于 Cas9 活性的升高和持续可能会导致脱靶效应、染色体易位和遗传毒性,因此在目标编辑后,Cas9 核酸酶活性必须迅速限制在一个狭窄的时间范围内。
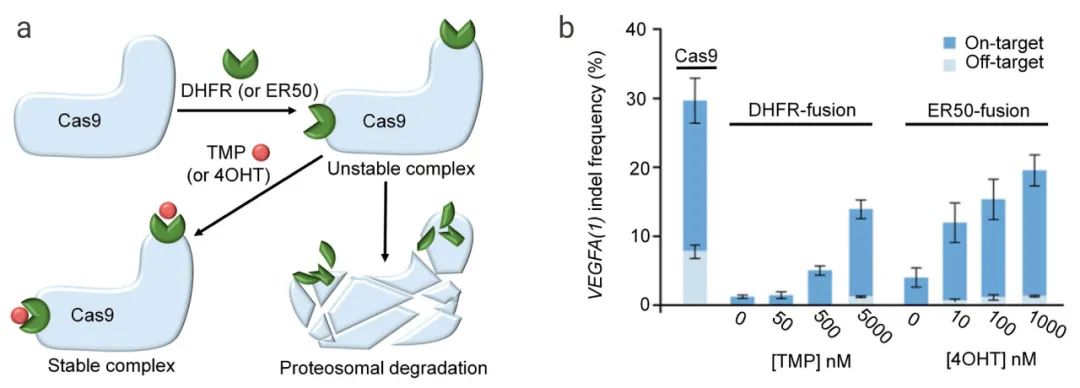
如下图 5 所示,DHFR (ER50)是一个不稳定的结构域,可快速靶向 Cas9 蛋白进行蛋白酶体介导的 Cas9 降解,但添加小分子抑制剂甲氧苄氨嘧啶 (TMP) 或 4-OHT 后可以使其稳定。用 Cas9-DHFR 或 Cas9-ER50 系统编辑 VEGFA 基因时,用不同剂量的TMP 或 4OHT 剂量依赖性控制靶向 VEGFA 基因的复合物 Cas9-DHFR (ERR50) 的靶向和非靶向活性。
相关产品 |
一种 RAD51 的激活剂,同时可增强 CRISPR/Cas9 的活性。 |
可逆的 microtubule 抑制剂。Nocodazole 抑制 Bcr-Abl,增强 CRISPR/Cas9 的活性。 |
一种内酯抗生素,是蛋白质运输的特定抑制剂。Brefeldin A 还是一种 CRISPR/Cas9 激动剂,可抑制 HSV-1病毒,并具有抗癌活性。 |
一种 DNA 连接酶 IV (DNA ligase IV) 抑制剂。SCR7 pyrazine 也是一种 CRISPR/Cas9 的增强子,可提高 Cas9 介导的同源性定向修复 (HDR) 的效率。 |
一种不稳定的形式,可以自动循环成稳定形式的 SCR7 pyrazine是一种 CRISPR/Cas9 的增强子,可提高 Cas9 介导的同源性定向修复 (HDR) 的效率 |
一种核苷逆转录酶抑制剂 (NRTI),有潜力用于 HIV 感染的研究。Zidovudine 增强 CRISPR/Cas9调节的编辑频率。 |
MCE 的所有产品仅用作科学研究或药证申报,我们不为任何个人用途提供产品和服务。
参考文献
2. Westermann L, Neubauer B, Köttgen M. Nobel Prize 2020 in Chemistry honors CRISPR: a tool for rewriting the code of life. Pflugers Arch. 2021 Jan;473(1):1-2.
3. Dominguez AA, Lim WA, Qi LS. Beyond editing: repurposing CRISPR-Cas9 for precision genome regulation and interrogation. Nat Rev Mol Cell Biol. 2016 Jan;17(1):5-15.
4. Matano M, Date S, Shimokawa M, Takano A, Fujii M, Ohta Y, Watanabe T, Kanai T, Sato T. Modeling colorectal cancer using CRISPR-Cas9-mediated engineering of human intestinal organoids. Nat Med. 2015 Mar;21(3):256-62.
5. Yang H, Wang H, Shivalila CS, Cheng AW, Shi L, Jaenisch R. One-step generation of mice carrying reporter and conditional alleles by CRISPR/Cas-mediated genome engineering. Cell. 2013 Sep 12;154(6):1370-9.
6. Sánchez-Rivera FJ, Jacks T. Applications of the CRISPR-Cas9 system in cancer biology. Nat Rev Cancer. 2015 Jul;15(7):387-95.
7. Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 Aug 17;337(6096):816-21.
8. Zalatan JG, Lee ME, Almeida R, Gilbert LA, Whitehead EH, La Russa M, Tsai JC, Weissman JS, Dueber JE, Qi LS, Lim WA. Engineering complex synthetic transcriptional programs with CRISPR RNA scaffolds. Cell. 2015 Jan 15;160(1-2):339-50.
9. Zhuo C, Zhang J, Lee JH, Jiao J, Cheng D, Liu L, Kim HW, Tao Y, Li M. Spatiotemporal control of CRISPR/Cas9 gene editing. Signal Transduct Target Ther. 2021 Jun 20;6(1):238.
联系邮箱:kefu@labbase.net
版权与免责声明
- 凡本网注明“来源:来宝网”的所有作品,版权均属于来宝网,转载请必须注明来宝网, //www.next-search.com,违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。