生物制品质量控制检测方法
- 爱必信(上海)生物科技有限公司2023年12月11日 10:58 点击:213
生物制品是指以微生物、寄生虫、动物毒素、生物组织作为起始材料,采用生物学工艺或分离纯化技术制备,并以生物学技术和分析技术控制中间产物和成品质量制成的生物活性制剂,包括菌苗、疫苗、毒素、类毒素、免疫血清、血液制品、免疫球蛋白、抗原、变态反应原、细胞因子、激素、酶、发酵产品、单克隆抗体、DNA重组产品、体外免疫诊断制品等。由于其特殊的性质,生物制品的质量控制至关重要,国家规定应当对生物制品的生产过程和中间产品的检验进行特殊控制,为响应这一要求,一系列生物制品生产研发过程中相关杂质的检测试剂盒诞生,大致可分为两大类,一类是检测细胞来源的污染物,例如来自包装细胞系或细菌的宿主细胞蛋白和DNA,另一类则是检测生产中使用的辅助病毒、质粒DNA、牛血清、核酸酶、蛋白酶、抗生素等物质。
细胞来源污染物检测
1、宿主细胞DNA/DNA片段残留检测
生物制品中的重组蛋白药、抗体药、疫苗等产品是用连续传代的动物细胞株表达生产,虽然经过严格的纯化工艺,但产品中仍有可能残余宿主细胞DNA,不同宿主细胞残留的DNA带来的潜在威胁并不相同,尽管它们有着相同的基本结构单位,但其片段长度不同,以不同的物理形式存在,进入人体后可造成多种多样的后果,如致癌性、感染性等。因此从安全角度,在生物制品的生产工艺对残留DNA进行检验验证不可或缺。
《中国药典》、《美国药典》和《欧洲药典》均提及用qPCR法对DNA残留量进行测定。TaqMan®荧光探针是一种寡核苷酸探针,其5’末端携带荧光基团(报告基团),如 FAM、TET、VIC等,3’端携带淬灭基团,如 TAMRA、BHQ1等。PCR扩增时在加入一对引物的同时加入一条特异性的荧光探针,探针完整时,荧光基团发射的荧光信号被淬灭基团吸收。PCR扩增时,Taq酶的5'-3'外切酶活性将探针酶切降解,使荧光基团和淬灭荧光基团分离,从而荧光监测系统(荧光定量PCR仪)可接收到荧光信号,即每扩增一条DNA链,就有一个荧光分子形成,实现了荧光信号的累积与PCR产物形成完全同步。该方法具有特异性强、灵敏度高等特点,在目前生物制药细胞核酸残留检测中被广泛使用。
表 《中国药典》2020版部分疫苗生物制品残留DNA标准
来源 | 细胞 | DNA残留标准 |
冻干乙型脑炎灭活疫苗 | Vero细胞 | 100pg/剂 |
双价肾综合征出血热灭活疫苗 | Vero细胞 | 100pg/剂 |
冻干人用狂犬疫苗 | Vero细胞 | 3ng/剂 |
Sabin株脊髓灰质炎灭活疫苗 | Vero细胞 | 50pg/剂 |
重组乙型肝炎疫苗 | CHO细胞 | 10pg/剂 |
2、宿主蛋白(HCP)残留检测
宿主蛋白即由宿主细胞产生的蛋白,包括目的蛋白和宿主细胞本身的蛋白,它的存在可能诱发不良免疫反应,也可能导致药效发生变化,因此需要对原料药和下游纯化过程(DSP)中间体中的HCP进行表征和量化。多国药典规定酶联免疫法(ELISA)作为HCP定量方式,《中国药典》2020版明确规定CHO细胞残余蛋白占总蛋白含量要保持在0.05%以下。
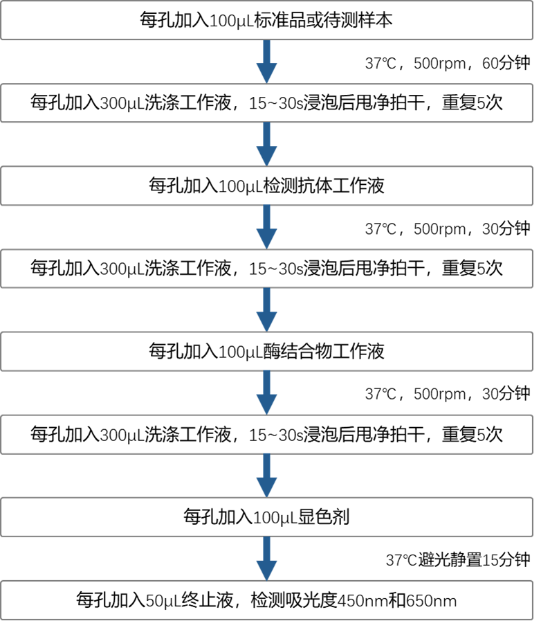
图 Absin CHO HCP ELISA Kit(abs590005)快速操作流程
工艺杂质残留检测
1、培养添加剂残留检测
细胞培养是生物制品生产过程中经常用到的手段,牛血清更是被广泛使用,为细胞生长提供必须的营养成分,BSA则是在牛血清中大量存在,然而BSA作为外源性蛋白如果跟随药物产品进入人体,将引发严重的免疫反应并有可能影响药物效果,因此《中国药典》2020版对各种疫苗BSA的残留量都进行了明确的规定,基本是不高于50ng/mL或者不高于50ng/剂,并且药典也推荐了酶联免疫吸附法用于BSA的含量测定。
除了牛血清外,各类抗生素亦是细胞培养过程中不可或缺的添加剂,如卡那霉素、庆大霉素等,ICH(人用药品注册技术要求国际协调会)将生物制品中的残留抗生素列为工艺相关杂质,要求“通过研究证明其在工艺中可有效控制或去除,并达到可接受的水平”,《中国药典》2020版明确规定对疫苗等预防类产品采用酶联免疫法测定抗生素残留,应<50ng/剂。
2、Protein A残留检测
Protein A有着与某些免疫球蛋白(特别是IgG)的Fc部分的高亲和力,因此Protein A亲和层析柱被广泛应用于抗体类药物的分离纯化,但是在使用过程中,由于待纯化物中存在蛋白水解酶,会水解Protein A,导致部分Protein A脱落并与抗体结合残留在洗脱液中,Protein A具有免疫原性,若进入体内可能引起不良免疫反应,因此对于残留量需要做质控。
3、胶原酶I型残留检测
胶原酶广泛用于将组织消化成单细胞,消化得到的单细胞被用于进一步生产生物制品,生物制品生产相关法规中明确了细胞培养相关材料检测的必要性,故胶原酶的残留量检测也愈发引起重视。
4、内毒素检测
内毒素是一种脂多糖,来自革兰氏阴性细菌的细胞壁,会在细菌死亡或自溶后被释放,当内毒素进入生物体,可能引起发热反应,因此也是影响生物制品安全性的重要因素之一,《中国药典》2020版规定用鲎试剂进行内毒素检测。
鲎试剂是一种从动物鲎的血液中提取的生物试剂,能够和内毒素发生反应,产生凝集沉淀,再应用凝胶法或光度测定法检测生物制品中内毒素的含量,为了符合可持续发展的原则,科学家们研发出了重组鲎试剂,以替代传统鲎血提取物,从操作流程与分析方法上做到了无感替代。

图 鲎与鲎试剂检测原理
参考资料
[1] 国家药典委员会.中国药典[M].北京:中国医药科技出版社,2020:1088.
Absin提供生物制品质量控制检测试剂盒
货号 | 产品名称 | 规格 |
Human IgG ELISA Kit | 96T | |
CHO细胞 HCP(宿主蛋白)残留检测试剂盒 | 96T | |
BSA残留检测试剂盒 | 96T | |
Protein A残留检测试剂盒 | 96T | |
卡那霉素残留检测试剂盒 | 96T | |
庆大霉素残留检测试剂盒 | 96T | |
胶原酶I型残留检测试剂盒 | 96T | |
质粒DNA残留(qPCR)检测试剂盒 | 100T | |
宿主细胞残留DNA(磁珠法)样本前处理试剂盒 | 100T | |
HEK293残留DNA(qPCR)检测试剂盒 | 100T | |
HEK293残留DNA片段(qPCR)检测试剂盒 | 100T×4 | |
293T细胞残留DNA(qPCR)检测试剂盒 | 100T | |
293T细胞残留DNA片段(qPCR)检测试剂盒 | 100T×4 | |
Human残留DNA(qPCR)检测试剂盒 | 100T | |
Human残留DNA片段(qPCR)检测试剂盒 | 100T×4 | |
Hela细胞残留DNA(qPCR)检测试剂盒 | 100T | |
Hela细胞残留DNA片段(qPCR)检测试剂盒 | 100T×4 | |
E1A残留DNA(qPCR)检测试剂盒 | 100T | |
E1A&SV40LTA残留DNA(qPCR)检测试剂盒 | 100T | |
E.coli残留DNA(qPCR)检测试剂盒 | 100T | |
E.coli总RNA残留(qPCR)检测试剂盒 | 100T | |
CHO残留DNA(qPCR)检测试剂盒 | 100T | |
Vero残留DNA(qPCR)检测试剂盒 | 100T | |
Vero残留DNA片段(qPCR)检测试剂盒 | 100T×4 | |
毕赤酵母残留DNA(qPCR)检测试剂盒 | 100T | |
PG13残留DNA(qPCR)检测试剂盒 | 100T |
联系邮箱:kefu@labbase.net
版权与免责声明
- 凡本网注明“来源:来宝网”的所有作品,版权均属于来宝网,转载请必须注明来宝网, //www.next-search.com,违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。







