调节内皮屏障功能的机械信号通路
- 上海泉众机电科技有限公司2024年1月22日 10:00 点击:136
血管由单层内皮细胞排列,血管内皮细胞界于血液和间质组织之间发挥其屏障作用。内皮细胞的通透性受到严格调控,通透性增加与包括动脉粥样硬化在内的许多疾病有关。内皮细胞持续暴露于流动血液施加的机械力,尤其对剪切应力特别敏感,这是内皮功能的关键决定因素。不受干扰的血流可促进内皮弹性并降低对大分子的渗透性,而受干扰的血流会导致内皮功能障碍和屏障破坏。最近,来自英国皇家兽医学院对比生物医疗科学系的 Anna McQueen 和 Christina M Warboys 研究员在Current Opinion in Cell Biology 期刊发表了题为“Mechanosignalling pathways that regulate endothelial barrier function”的一项研究综述,概述了其对受干扰和未受干扰的血流如何调控细胞旁通透性和跨细胞通透性的理解的最新进展,并强调了可能构成限制心血管疾病治疗基础的潜在细胞靶点。
动脉粥样硬化斑块的形成是一个漫长的过程,斑块形成在暴露于不均匀(紊乱)血流的动脉区域,揭示了血流动力学应力在动脉粥样硬化中的重要性。剪切应力是内皮功能的关键决定因素,剪切应力的大小和方向都很重要。
虽然人们普遍认为单向、高幅度的剪切应力(10-40 dyn/cm²)与细胞保护机制的激活和防止内皮功能障碍和动脉粥样硬化有关,关于低幅度(< 5 dyn/cm²)、振荡(双向)和多向流动剪切应力对动脉粥样硬化的贡献仍然存在争议。最近的研究强调了多向流动在促进内皮功能障碍和动脉粥样硬化中的重要性,然而,低时间-平均壁面剪切应力(WSS)的作用尚不清楚,关于其在斑块形成中的作用的证据相互矛盾。
同样重要的是要考虑用于研究剪切应力对内皮细胞影响的不同体外方法,因为所产生的血流动力学曲线可能会有很大差异,并且取决于所使用系统的配置。平行板流动室、锥形和平板粘度计以及微流体装置通常用于使细胞暴露于单向或振荡血流,而多向血流可以使用旋流井(轨道振动器)方法或通过改装平行板流动室来实现,但大多数常用的体外系统还不能在不产生低时间平均壁面剪切应力的情况下诱导多向流动。
扰动血流和未扰动血流对内皮细胞的不同影响可能归因于不同机械敏感转录因子的激活。转录因子Krüppel样因子4(KLF4)、Krüppel样因子2(KLF-2)和核因子-红细胞2相关因子2(Nrf-2)在暴露于血流的内皮细胞中优先被激活,而暴露于血流紊乱的内皮细胞表现出活化B细胞核因子κ轻链增强子(NF-κB)、激活蛋白-1 (AP-1)、YAP/TAZ/TEAD 和缺氧诱导因子1α(HIF-1α)的富集,导致内皮功能障碍。血流紊乱会促进炎症信号传导、细胞凋亡、氧化应激、内皮间充质转化和衰老。剪切应力还调节内皮屏障功能,体内和体外研究均表明,暴露于血流紊乱的内皮细胞对白蛋白和低密度脂蛋白(LDL)的通透性增加。
物质可以通过细胞旁途径或跨细胞途径在内皮细胞间转运。内皮细胞旁通透性主要受两种类型的细胞间连接调节:紧密连接和黏附连接(图1)。内皮细胞的通透性随着连接完整性的丧失和内皮细胞间局灶间隙的形成而增加。内皮通透性在连接完整性丧失和内皮细胞之间缝隙形成后增加。
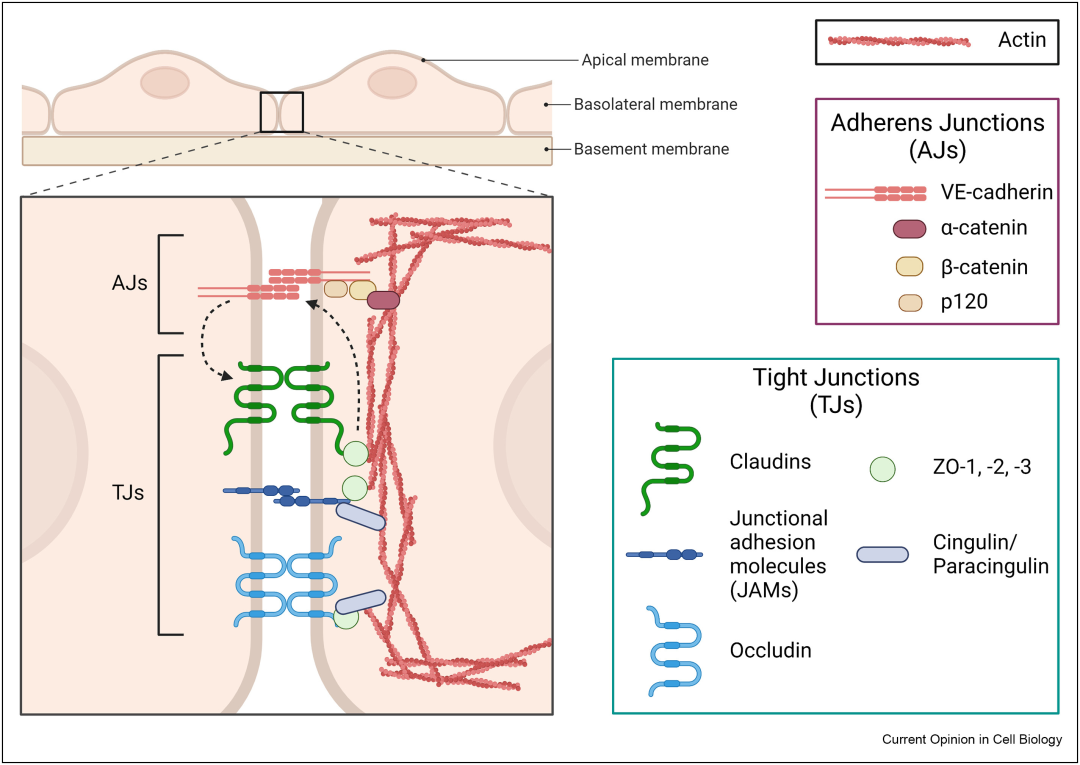
图1 细胞旁通透性受黏附连接和紧密连接的调节。黏附连接是由相邻内皮细胞上跨膜的VE-钙粘蛋白之间的相互作用形成的。紧密连接是由相邻内皮细胞上跨膜的闭合蛋白(occludin)、密封蛋白(claudin)、连接粘附分子(JAM)之间的相互作用形成的。黏附连接和紧密连接之间的串扰使屏障功能以协调的方式调节。
长期以来,关于大分子在内皮细胞中的主要转运途径以及剪切应力如何影响这些途径一直存在争议。长期以来,人们普遍认为,大分子通过细胞有丝分裂或细胞凋亡时产生的 “leaky junctions” 穿过内皮屏障。一种直接可视化培养内皮细胞运输途径的方法的发展澄清了其中的许多问题,并观察到存在三种转运途径:白蛋白大小的示踪剂通过双细胞和三细胞连接通过细胞旁途径穿过内皮细胞,高密度脂蛋白大小的示踪剂仅发生在三细胞连接处,LDL大小的示踪剂通过胞吞作用跨内皮细胞转运。研究还显示,在暴露于扰动血流的内皮细胞中,与未扰动流相比,渗漏的三细胞连接数量增加,通透性也增加。迄今为止,三细胞连接在内皮功能障碍和动脉粥样硬化中的作用很少受到关注,因此是进一步研究的重要领域。
最近的研究确定了新的渗透性调节途径,或对先前描述的途径提供了额外的见解(图2)。例如,p21活化激酶(PAK)长期以来一直被认为可以增加内皮细胞在血流受到干扰时的细胞旁通透性,然而,机制尚不清楚。最近研究表明,含有 SH2/SH3结构域的衔接蛋白,酪氨酸激酶-1(Nck1)的非催化区,在响应紊乱的血流时被激活,这介导了紊动流依赖性的 PAK 激活。Nck1 的缺失可阻止 PAK 募集到细胞连接处,并显著抑制扰动流诱导的细胞旁通透性。此外,最近的研究发现,在扰动流下,TWIST1 增加 EVA1A(Eva-1 同源物A)的表达,从而促进屏障破坏;扰动流通过 Frizzled-4-β-连环蛋白依赖性机制增加细胞旁通透性;在暴露于扰动流的内皮细胞中,G蛋白偶联受体激酶2(GRK2)增加了黏着斑蛋白在 Ser721 上的磷酸化,这导致黏着斑蛋白失活,黏附连接被破坏,细胞旁通透性增加;还表明转化生长因子-β(TGF-β)I型受体,也称为ALK5,有助于干扰流动依赖性屏障破坏。
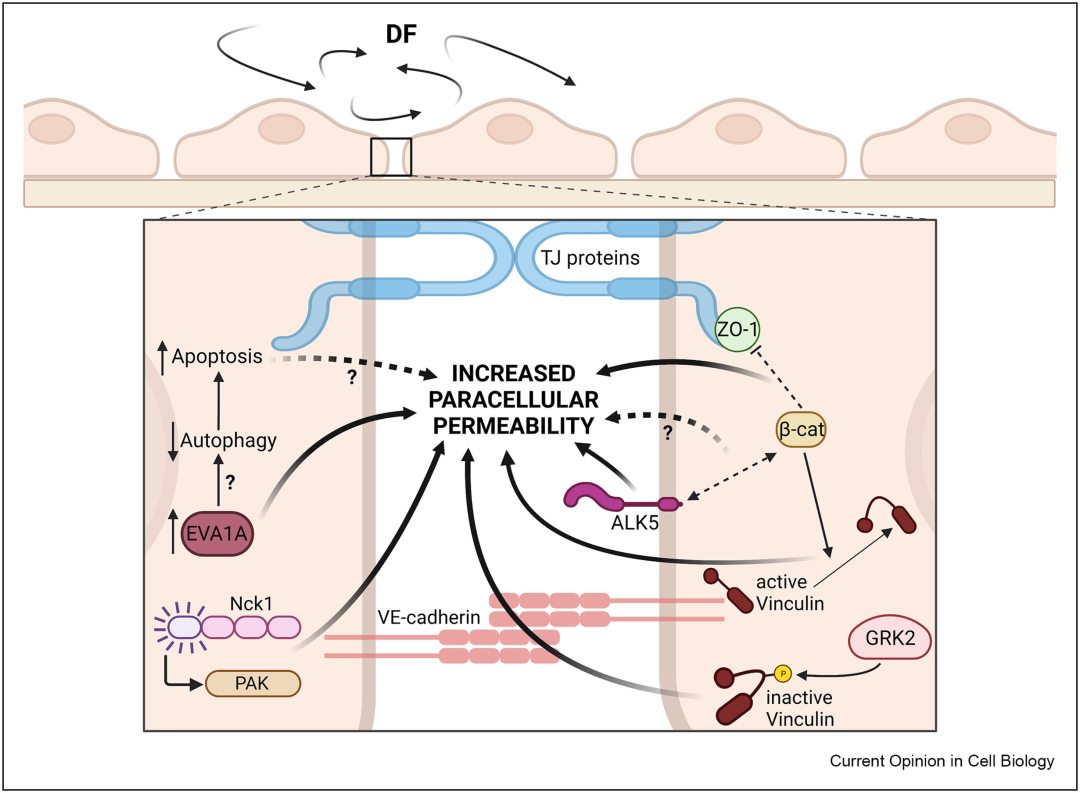
图2 破坏内皮屏障功能稳定的机械信号通路。扰动血通过破坏黏附连接和紧密连接的稳定性来诱导内皮屏障破坏。Nck1 被扰动流激活,从而促进 PAK 与 VE-钙粘蛋白的结合。PAK会破坏黏附连接并增加渗透性。扰动流也会增加EVA1A的表达,从而促进屏障破坏。流动紊乱还通过增加β-连环蛋白信号传导来增加通透性,从而降低 ZO-1 的表达并减少黏着斑蛋白对细胞连接的定位。当血流受到干扰时,GRK2被激活,从而促进了血管蛋白在远离细胞连接处的重新分布。在扰动流介导的 ALK5 激活后,通透性也增加。
虽然人们普遍认为动脉粥样硬化保护性剪切应力会降低对大分子的渗透性并稳定内皮屏障功能,但对所涉及的精确机械信号通路的研究很少。一项新的研究强调了长链非编码RNA转移相关肺腺癌转录本1(lnc-RNA MALAT1)在维持屏障完整性方面的作用。急性暴露于未受干扰的血流导致 MALAT1 上调,从而增加 ZO-1 和闭合蛋白的表达。据推测,这会改善屏障功能,尽管这仅在静态条件下进行了研究。其他研究强调了内皮细胞TEK酪氨酸激酶(Tie2)和激肽释放酶10(KLK10)在内皮细胞暴露于扰动流时增强屏障功能的重要作用。(图3 总结了这些途径)
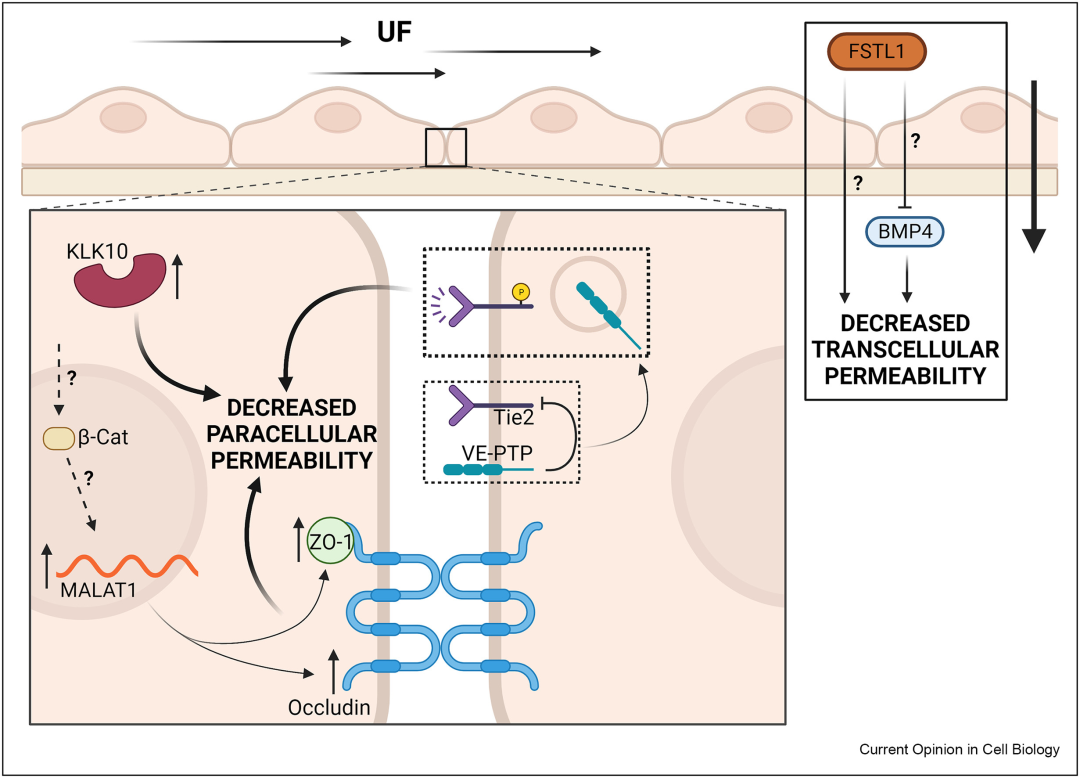
图3 稳定内皮屏障功能的机械信号通路。不受干扰的血流通过增加 lnc-RNA MALAT-1 的表达来促进内皮细胞连接的稳定,从而增加 ZO-1 和闭合蛋白的表达。通过增加VE-PTP的内化,KLK10对未受干扰的血流的上调也降低了渗透率。这导致 Tie2 的激活增强,从而稳定VE-钙粘蛋白。不受干扰的血流还通过增加卵泡抑素样蛋白1(FSTL-1)的表达来降低跨细胞通透性。FSTL-1 部分通过抑制骨形态发生蛋白4(BMP4)信号传导来降低通透性。
最近的研究揭示了通过剪切应力调节内皮细胞通透性的重要新见解(图2、图3),并强调了许多信号分子,这些信号分子可以靶向稳定连接,从而降低细胞旁通透性和内皮功能障碍。这些可以作为预防策略的一部分,与他汀类药物和抗炎疗法一起,进一步限制动脉粥样硬化的发展和进展。低密度脂蛋白转运的改变也可能提供另一个重要靶点,以限制胆固醇在血管壁内的沉积并预防心血管疾病。迄今为止,这是一个研究不足的领域,特别是考虑到它在动脉粥样硬化中的重要性,最近对其在内皮细胞生理流动条件下主要转运途径的发现,有望为进一步研究其调控提供平台。
参考文献:McQueen A, Warboys CM. Mechanosignalling pathways that regulate endothelial barrier function. Curr Opin Cell Biol. 2023 Oct;84:102213. doi: 10.1016/j.ceb.2023.102213. Epub 2023 Jul 31. PMID: 37531894.
原文链接:https://pubmed.ncbi.nlm.nih.gov/37531894/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。如有任何的想法以及建议,欢迎联系小编。感谢各位的浏览以及关注!
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
点击了解
细胞流体剪切力|共培养|压力培养|牵张应变|血管培养|平行平板流动腔|仪器|上海泉众机电科技有限公司Naturethink
http://www.naturethink.com/
Naturethink剪切力|细胞切应力|流体剪切应力|细胞流体剪切力|fluid shear stress|细胞体外培养|仿血流剪切应力培养系统
http://www.naturethink.com/?product/58.html
联系邮箱:kefu@labbase.net
版权与免责声明
- 凡本网注明“来源:来宝网”的所有作品,版权均属于来宝网,转载请必须注明来宝网, //www.next-search.com,违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。







