内毒素的分离提取和纯化方法介绍
- 科德角国际生物医学科技(北京)有限公司2024年1月12日 2:43 点击:120
从20世纪30年代至今,根据内毒素的理化性质而设计的分离、鉴定内毒素的技术方法主要有下述几种:
一、分离提取
(一)三氯醋酸法
Boivin和Messrobeanu于1935年,将活菌或经冷冻干燥的大肠杆菌,在4℃条件下与0.25N的三氯醋酸共同振荡或剧烈搅拌,将细菌细胞裂解,使LPS分子从破溃的细胞外膜上游离出来。离心后取上清液经浓缩后,加2倍体积的冷冻乙醇,将生成的沉淀物溶解、浓缩后冷冻干燥,即得到LPS干粉。此法提取的LPS含有10%左右的菌体蛋白,这些蛋白质可影响LPS的理化性质和生物学活性。
(二)酚-水法
wesphal和luederitz于1952年为分离含蛋白质较低的LPS而建立的方法,以后被广泛应用于水溶性S-LPS的提取。具体过程为:在细菌的水溶液中,加入等量90%的酚将细胞裂解,使内毒素分子从破溃的细胞外膜上游离出来。68℃,振荡10~15min后,冷却、离心,收集富含LPS的水相,并反复用水萃取3~5次,然后将水相浓缩、冷冻于燥,得到粗提的LPS,将粗制品溶解于水,高速离心(100000g,2~3h),得到颗粒状LPS后再溶于水中冷冻干燥。此法提取的LPS纯度较高,蛋白质含量为1%~3%。
(三)酚-氯仿-石油醚法
由Galanos设计的提取R-LPS的方法。预先经乙醇、丙酮、乙醚脱脂后的干燥菌,用90%苯酚﹑氯仿及石油醚按2∶5∶8所组成的混合提取液提取2~3次,取酚相,得到LPS和孔蛋白(porin)提取液,用减压法去除溶媒,加水形成沉淀,并洗涤3~5次,然后再用80%苯酚复溶,减压干燥,得到的LPS粗制品溶于水,超速离心取沉淀,即得到LPS纯品。此法纯化得到的LPS,不含核酸和多聚糖,蛋白质含量可控制在1%以下。
(四)水-丁醇法
由Morrison等于1975年设计。水-丁醇法较酚法简便,温和,适用于提取大肠杆菌和沙门菌的LPS;所得制品含蛋白量约1%。但此方法仍存在一些不足,由于丁醇不能灭活制品中酶类,导致在制备过程和储存时,Lipid A常发生降解。
二、纯化
(一)离子交换层析法
利用阳离子树脂非特异性的吸附带负电荷LPS的性质,将LPS从流动相中分离纯化出来。
(二)亲和层析法
利用多粘菌素B特异性结合LPS的特性,将多粘菌素B包被于聚丙烯胺树脂等高分子聚合物的表面,制成特异性结合LPS的层析柱,即可对LPS进行亲和层析法纯化。
(三)金属离子和小分子量多胺成分的去除
通常情况下,未提纯的LPS溶液中存在大量的小分子带电物质,如Mg2+ 、Ca2+和少量的Fe2+ 、A13+、Zn2+、Na+等离子及乙醇胺、腐胺﹑精胺、亚精胺及尸胺等小分子量多胺。它们中和LPS分子上带负电荷的磷酸基团,使得本可以用带电荷的吸附剂将LPS除去的效果明显降低。电透析便是通过离子交换的方法进行LPS纯化的。其原理就是将很多的阴/阳离子交换膜交错地串联在一起,电解质溶液则在膜间流动,两侧施加直流电之后溶液中阳离子(如无机阳离子、生物碱等)向阴极移动而阴离子(如无机阴离子、有机酸等)向阳极移动。其中阴离子可顺利通过阴离子膜,但再往前移动时却被邻近的阳离子膜挡住。同样,阳离子也可以顺利地通过阳离子膜而无法通过阴离子膜。中性化合物及高分子化合物则留在透析液中,最终得到纯化的提取物(图2-6)。
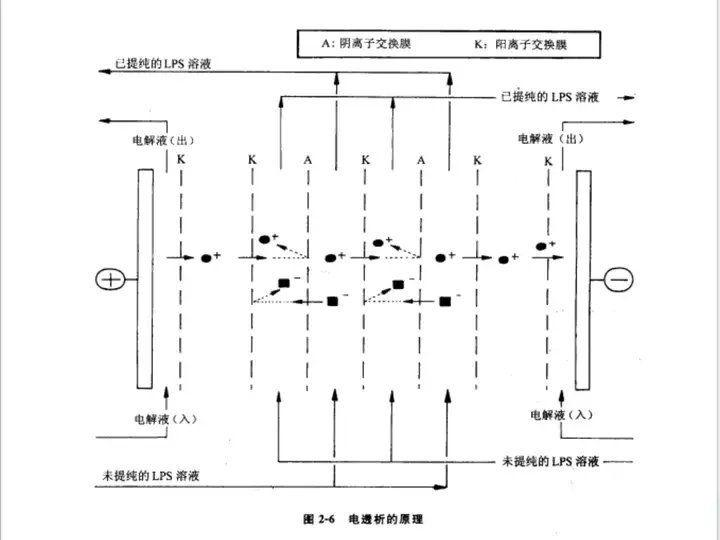
由于提取的LPS中含有较多带正电荷的杂质,因此在LPS的电透析过程中可发现阴极的pH值升高,阳极的pH值变化不明显的现象。电透析过程中LPS溶液的pH值常有一定程度的下降,同时由于有稳定LPS多聚体功能的Mg2+ 、Ca2+等离子成分被除去,LPS多聚体变为单体而发生沉淀。为避免此现象,需用NaOH或三乙胺将其中和到pH 7.0左右,使其形成中性的、高水溶性的LPS钠盐和LPS三乙胺盐而重新溶解。电透析结束时,LPS一般为酸性产物,此酸性LPS在水中的溶解度极低,可直接进行冻干处理,-4~-20℃低温保存,每次使用前可用不同的碱中和转化成所需要的LPS盐。
(四)核酸成分的去除
根据LPS与核酸片段在分子量上的差异,可用超速离心法、电泳法等方法将其去除。
联系邮箱:kefu@labbase.net
版权与免责声明
- 凡本网注明“来源:来宝网”的所有作品,版权均属于来宝网,转载请必须注明来宝网, //www.next-search.com,违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。








