缺氧预处理人华通胶间充质干细胞在直接接触共培养系统中减轻应激诱导的细胞凋亡并改善人胰岛存活和功能
- 上海泉众机电科技有限公司2023年3月20日 11:06 点击:268
胰岛细胞移植已成为一种潜在的细胞疗法,可为遇到严重低血糖发作的特定 1 型糖尿病患者恢复葡萄糖稳态。细胞凋亡是导致移植的胰岛细胞死亡的最重要因素。胰岛破坏的早期引发因素是缺氧,损害β细胞功能和存活。缺氧还通过活性氧(ROS)的过量产生诱导氧化应激,导致移植前后细胞凋亡。因此,有必要通过临床上可行的方法来抑制细胞凋亡并提高胰岛质量,以获得更好的移植结果。
一些研究表明,间充质干细胞(MSCs)在培养期间和移植后通过分泌旁分泌因子或直接接触细胞和细胞外基质产生对胰岛的存活和功能具有支持作用。氧浓度是影响间充质干细胞的重要因素。研究表明,缺氧预处理的MSC(Hpc-MSCs)在1-7% O2在短时间内激活Akt和细胞外调节激酶(ERK)信号通路,显著增强抗凋亡,抗氧化,促生存和促血管生成因子的产生,例如Bcl-2、VEGF、HGF、过氧化氢酶和Ho-1。移植的HPC-MSCs在肺纤维化、心肌损伤、急性肾脏、脑和肝脏损伤等多种疾病中显示出有效的治疗效果。然而,关于Hpc-MSCs与胰岛细胞共培养或共移植的研究非常有限,需要更多的研究。
基于此,伊朗德黑兰医科大学、设拉子医科大学科研团队的一项研究曾探讨了HPC-MSCs在直接和间接共培养体系中是否能降低应激因子,抑制线粒体凋亡通路,改善人胰岛生存和功能,该研究使用了Wharton's Jelly 来源的MSC(WJ-MSCs),因为与其他来源的MSCs相比,它不表达主要的组织相容性复合体II类(MHC-II),更容易获得,并且增殖能力更高。

HPC-MSCs和Nc-MSCs中VEGF分泌的比较
为了证实缺氧对WJ-MSCs的积极作用,实验首先评估了在缺氧(HPC-MSCs,5% O2,5% CO2)和正常条件(Nc-MSCs,20% O2,5% CO2)下培养24小时后的血管内皮细胞生长因子(VEGF)分泌(缺氧增强的生长因子之一)。结果显示,HPC-MSCs中的VEGF含量几乎是Nc-MSCs的3倍。
WJ-MSCs 在培养期间增加了人类胰岛的存活率
生存评估显示,在培养期间,对照组中胰岛细胞存活率约为25%,与MSCs共培养将胰岛细胞存活率提高到100%。HPC-MSCs和Nc-MSCs共培养组的存活率相似,两者之间无显著差异(图1)。
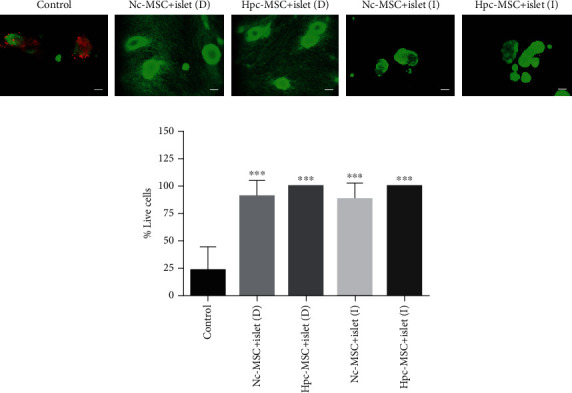
图1 与Hpc-MSCs和Nc-MSCs共培养的人胰岛存活率。
WJ-MSCs在培养期间抑制人胰岛细胞凋亡
对照组中凋亡胰岛细胞的百分比约为70%,而与WJ-MSCs共培养将胰岛细胞死亡率降低至10% 以下。两个直接共培养组的减少量比间接共培养组更显著,但Hpc-MSCs组和Nc-MSCs组之间没有差异(图2)。
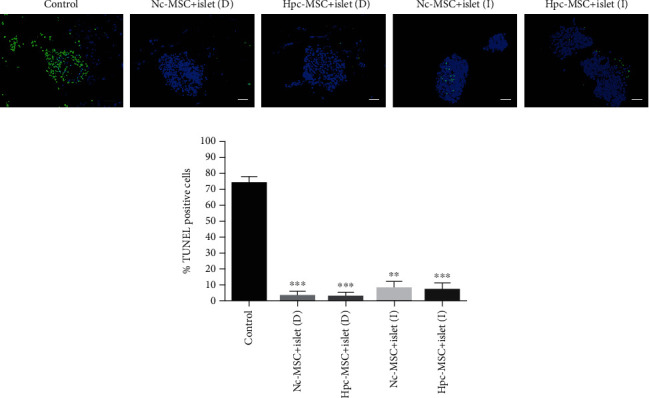
图2 与HPC-MSCs和Nc-MSCs共培养的人胰岛细胞的凋亡。
共培养胰岛细胞中Bcl-2增加,Bax和Caspase-3 减少
在共培养胰岛细胞中,抗凋亡标志物Bcl-2显著增加,促凋亡标志物 Bax在基因表达和蛋白质水平上显著降低。HPC-MSCs组和Nc-MSCs组之间没有明显差异。caspase-3 蛋白作为细胞凋亡的主要指标,在共培养胰岛细胞中得到显著降低。caspase-3 的基因表达在所有共培养组中也降低,但是在任何组中都不显著。
直接共培养的 HPC-MSCs 组显著提高了胰岛功能
所有共培养胰岛细胞的胰岛素和C肽分泌均增加。直接共培养组的增量大于间接共培养组。然而,仅在直接共培养的HPC-MSCs组中观察到显著增加(图3 a、b)。所有共培养组的胰岛素mRNA水平均增强。在直接共培养的 Hpc 和 Nc-MSCs 组中均观察到统计学意义(图3 c)。

图3 葡萄糖刺激(a)C肽和(b)胰岛素分泌物以及(c)胰岛素mRNA表达在与Hpc-MSCs和Nc-MSCs共培养的人胰岛细胞中的表达。
HIF-1α在胰岛中检测到,在共培养组中降低
HIF-1α蛋白作为缺氧的主要标志物,在缺氧条件下均有表达,但在共培养的胰岛中存在WJ-MSCs时降低。与对照组相比,胰岛细胞共培养组HIF-1α mRNA表达降低,但下降不显著。这可能与缺氧条件下HIF-1α在蛋白质稳定性水平上的调控有关。
WJ-MSCs 存在下抑制 p53 蛋白
p53蛋白被检测为HIF-1α在长时间缺氧条件下稳定的下游靶点之一。结果显示,p53仅存在于对照组中,并且在所有共培养胰岛细胞中均受到抑制,提示WJ-MSCs对胰岛细胞凋亡具有抗凋亡作用(图4)。

图4 与 Hpc-MSCs 和 Nc-MSCs 共培养的人胰岛中的 p53 蛋白水平。
WJ-MSCs 存在下 ROS 显著降低
实验还在离体胰岛中测量与诱导细胞凋亡相关的氧化标记物ROS的产生。在培养后,还检测了Nc-MSCs和Hpc-MSCs中单独的ROS量,以恢复共培养组的标准化。将胰岛对照组和共培养组进行比较(图5)。ROS产量在胰岛对照组中最高,而在与HPC-MSCs和Nc-MSCs间接共培养的胰岛中较低。在接触MSC的情况下,ROS的产量是所有胰岛组中最低的。这可能表明间充质干细胞对分离的胰岛细胞具有抗氧化作用。培养5 天后,Nc-MSCs(对照)中的ROS量低于Hpc-MSCs(对照)组,但差异不显著。

图5 与 Hpc-MSCs 和 Nc-MSCs 共培养的人类胰岛细胞中的 ROS 产生。
与 Hpc-WJ-MSCs 共培养胰岛细胞中的 VEGF 显著增强
VEGF mRNA在胰岛对照组中最低,而在与Hpc-MSCs和Nc-MSCs直接接触和间接接触共培养的胰岛细胞中诱导的VEGF mRNA转录水平相对较高。然而,这仅在直接和间接 HPC-MSCs 共培养组中显著观察到(图6 a)。
在胰岛对照组和胰岛共培养组中也评估了VEGF分泌。将胰岛对照组和共培养组进行比较(图6 b)。VEGF分泌在HPc-MSCs共培养组(直接和间接)中最高,在Nc-MSCs共培养组中中等,在胰岛对照组中最低。有趣的是,在培养5天后,单独Hpc-MSCs中的VEGF含量仍然高于Nc-MSCs。

图6 与Hpc-MSCs和Nc-MSCs共培养的人胰岛中的VEGF分泌和mRNA表达。
鉴于胰岛在1型糖尿病治疗中的应用前景广阔,因此有必要关注与胰岛的最佳分离,培养期和移植相关的所有方面。综上所述,该研究表明,Hpc-WJ-MSCs作为移植前培养的支持细胞,可以保护离体的人胰岛细胞免受应激诱导的细胞凋亡,为移植成功提供可存活胰岛和提升胰岛功能,特别是通过直接共培养系统。
参考文献:Keshtkar S, Kaviani M, Jabbarpour Z, Sabet Sarvestani F, Ghahremani MH, Esfandiari E, Hossein Aghdaei M, Nikeghbalian S, Shamsaeefar A, Geramizadeh B, Azarpira N. Hypoxia-Preconditioned Wharton's Jelly-Derived Mesenchymal Stem Cells Mitigate Stress-Induced Apoptosis and Ameliorate Human Islet Survival and Function in Direct Contact Coculture System. Stem Cells Int. 2020 Dec 17;2020:8857457. doi: 10.1155/2020/8857457. PMID: 33381188; PMCID: PMC7759420.
原文链接:https://pubmed.ncbi.nlm.nih.gov/33381188/
小编旨在分享、学习、交流生物科学等领域的研究进展。如有侵权或引文不当请联系小编修正。
微信搜索公众号“Naturethink”,了解更多细胞体外仿生培养技术及应用。
联系邮箱:kefu@labbase.net
版权与免责声明
- 凡本网注明“来源:来宝网”的所有作品,版权均属于来宝网,转载请必须注明来宝网, //www.next-search.com,违反者本网将追究相关法律责任。
- 本网转载并注明自其它来源的作品,目的在于传递更多信息,并不代表本网赞同其观点或证实其内容的真实性,不承担此类作品侵权行为的直接责任及连带责任。其他媒体、网站或个人从本网转载时,必须保留本网注明的作品来源,并自负版权等法律责任。
- 如涉及作品内容、版权等问题,请在作品发表之日起一周内与本网联系,否则视为放弃相关权利。







