百世传媒|Best Media 携手中药学会制药工程专业委员会在化学仿制药、改良型新药和创新药国际峰会领域已深耕十余年,其中“仿制药国际峰会亚洲-GIS Asia”, “给药系统与制剂研发亚洲峰会-DDF Asia”,及“创新药国际峰会|NIS” 已多次举办,均已成为深受业界同仁认可的高质量行业领军峰会。
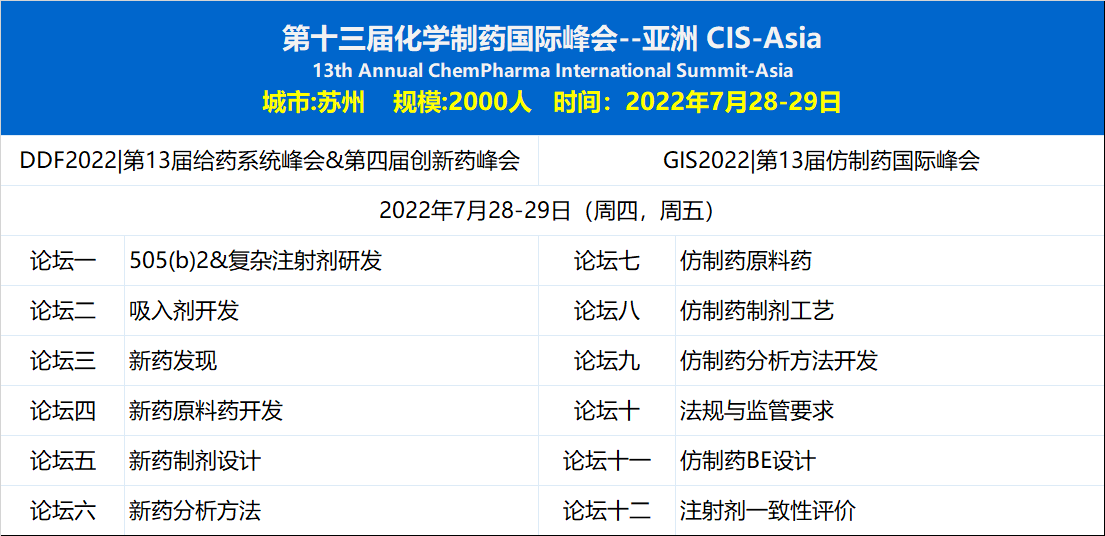
CIS-Asia 2022 (苏州)作为化药领域品牌第一峰会,将致力于国内药企的加速往前。本次峰会将通过三大主论坛,12大分论坛,邀请近150位国际国内一线大咖从战略、技术、市场,法规,临床等多角度,分享仿制药,505(b)2,创新药方面的最新技术和经验,同时汇聚2000位业内同仁,150家赞助企业共商发展大势与技术细节,共同助力国内药企研发。期待与您相会苏州。
参会注册通道及展商参展通道现已开通
期待与您相会苏州
扫描下方二维码填写报名信息进行详细咨询

我们的工作人员将于24小时内和您联系!
CIS2022 苏州 赞助商

CIS-Asia2022 已确认演讲嘉宾

第四届创新药国际峰会
7月28-29日(周四~周五)
大会 全体大会
7月28日(周四)
主办方致欢迎词
08:20 大会主持人致开幕词
俞雄,名誉主任委员,中国药学会制药工程专业委员会
08:30 面对多样化的临床需求,国内药企该怎样探索合适的研发产品
张连山,副总经理兼全球研发总裁,江苏恒瑞医药
09:05 模仿创新还是首创新药,自主研发还是组合创新,寻求新药研发新模式
王晶翼,前副总经理&全球研发总裁,四川科伦药业
09:40 3D,植入给药等新型前沿给药技术前景及市场机会分析
10:15 茶歇
10:45 国内企如何摆脱集采之争?未来国内药企竞争格局和机会?
11:15 国采压力下的药企的立项和开发策略
11:50 集体照
12:00 午餐
论坛一 505b2&新型复杂注射剂
7月28日(周四)
13:30 505b2新药成功的关键因素解析
李守峰,董事长,奥科达生物
14:15 改良型新药开发立题的合理性探讨
贾飞,副总经理,杭州百诚医药
14:45 中美505b2申报的对比和中国申报505b2的特殊挑战
卢恩先,总经理,上海奥全生物医药
15:30 茶歇
16:00 505b2 改良新药的临床研究:法规要求和研发策略
17:00 小组讨论:国内改良型新药的趋势和面临的瓶颈
王泽人,董事长/首席科学官,深圳药欣生物
朱海健,创始人兼总经理,力品药业
17:45 会议结束
7月29日(周五)
08:30 难溶药物增溶技术及其产品开发
吴传斌,创始人,新济药业
09:30 智能递药系统的研发思路和产业化前景
何仲贵,教授,沈阳药科大学
10:30 茶歇
11:00 复杂注射剂在改良新药中的应用和研发策略
12:00 午餐
13:00 复杂注射剂配方开发,生产工艺及技术转移要点
13:45 复杂注射剂的体内、体外评价考虑
14:30 茶歇
15:00 眼科制剂研发的特点-案例分析
欧阳晖,资深研发副总裁,因明生物
15:45 小组讨论:复杂制剂研发面临的挑战
王浩,董事长,上海惠永药物
16:30 会议结束
论坛二 吸入剂开发
7月28日(周四)
13:30 前沿技术在吸入制剂中的应用
毛世瑞,教授,沈阳药科大学
14:30 后疫情时代吸入制剂发展的痛点与展望(集采,疫情等新环境)
陈永奇,董事长,珠海瑞思普利
15:30 茶歇
16:00 吸入制剂改良型新药产品的开发思路及挑战-以仿生吸入微球为例
孙永达,首席科学家, 美国思瑞爱斯制药技术有限公司
17:00 小组讨论:高壁垒吸入剂开发,如何占据竞争优势
陈岚,高级副总裁,畅溪制药
17:45 会议结束
7月29日(周五)
08:30 吸入制剂改良型新药的立项和研发策略
黄才古,创始人、董事长兼CEO,谷森医药
09:15 话题确定中
符坚,研发技术总监,苏州海顺包装有限公司
09:45 吸入制剂的注册路径
10:30 茶歇
11:00 话题确定中
邵奇,所长助理,上海上药信谊药厂有限公司
12:00 午餐
13:00 吸入制剂一致性评价的挑战与策略
侯曙光,董事长兼总经理,四川普锐特药业有限公司
13:45 吸入制剂质量研究的特殊要求
杨永健,化学药品室主任,上海市食品药品检验所
14:30 茶歇
15:00 话题确定中
陈东浩,创始人和CEO,畅溪制药
15:45 小组讨论:吸入剂研发仿制,改良还是创新,企业如何选择
16:30 会议结束
论坛三 新药发现
7月28日(周四)
13:30 靶向CD73,肿瘤免疫小分子药物的开发
单波,首席科学官 ,德琪医药
14:30 基于AI的药物筛选和发现我们能够以多快的速度提供hit、lead和临床候选药物?
15:30 茶歇
16:00 指导变构小分子抑制剂优化的基于AI的蛋白质结构(命中率和临床候选率)
17:00 小组讨论:从CADD到AI,新药的发现会取代传统新药发现模式吗?
张寅生, 药物研究院副院长,正大天晴药业集团
17:45 会议结束
7月29日(周五)
08:30 抗癌多肽、小分子偶联药物方面(非ADC)的发展趋势和实践
邵军,首席运营官,同宜医药
09:30 乙型肝炎治疗性疫苗的研究进展
刘晓宇,创始人,成都凡诺西
10:30 茶歇
11:00 用于肺癌和结直肠癌的新型KrasG12C和Kras G12D共价小分子抑制剂的发现和评估
12:00 午餐
13:00 靶向蛋白质降解(TPD)药物发现(Cereblon E3连接酶调节剂/CELMoDs和Protac的案例研究)
李杰,首席科学官,勤浩医药
13:45 创新DNA复制起始蛋白(DRIPs)抑制剂高效抗癌药物研发
梁纯,联合创始人,恩康药业
14:30 茶歇
15:00 发现和开发针对NTRK、Ros1和Ret驱动癌症的小分子抑制剂
15:45 小组讨论:研发内卷,IPO收紧,创新药未来发展探讨
吴豫生,董事长/总裁,浙江同源康
利群,常务副总裁,捷思英达医药
刘东舟,首席科学官,华东医药
16:30 会议结束
论坛四 新药原料药开发
7月28日(周四)
13:30 创新药原料药开发中的技术转移
滕尚军,化学开发和生产副总经理,江苏亚盛医药
14:30 IND阶段的原料药工艺开发策略
赵富录,研究院院长,浙江海翔药业
15:30 茶歇
16:00 创新药原料药不同研发阶段的申报注册要求
张明平,副总经理,苏州瑞博生物
17:00 小组讨论:新技术如何辅助合成路线设计
冯向东,中国技术研发负责人,诺华
17:45 会议结束
7月29日(周五)
08:30 注册批起始物料选择与优化策略
09:15 新药原辅料颗粒与粉体性能评价
陆向云,应用科学家,麦克默瑞提克(上海)仪器有限公司
09:45 新药合成工艺路线的选择与评价
张霁,首席科学家,东阳光药业
10:30 茶歇
11:00 合成路线优化-案例分析
张福利,研究员,上海医药工业研究院
12:00 午餐
13:00 合成工艺开发中的质量控制
13:45 结晶与制品粒度分布
王龙虎,教授,中国药科大学
14:30 茶歇
15:00 话题确定中
卫宏远,教授,天津大学化工学院
15:45 小组讨论:如何降低成本选择合适的CDMO
16:30 会议结束
论坛五 新药制剂设计与研发
7月28日(周四)
13:30 创新药CMC研发策略的关键考虑因素与风险管理-案例分析
魏恒旭,药学与注册部门副总裁,睿跃生物科技
14:30 创新药CMC综合开发阶段成功使用CRO/CDMO加速研发-案例分析
刘福强,副总裁兼CMC负责人,贝达药业
15:30 茶歇
16:00 药物研发中辅料的临床和法规考虑
温弘,合伙人,上海生物医药基金
17:00 小组讨论:如何利用与阶段相适当的制剂开发来加速创新药开发
胡邵京,创始人,思康睿奇(上海)药业
17:45 会议结束
7月29日(周五)
08:30 如何提升难溶性APIs的溶解度
郭玉申,药学副总裁,亚虹医药
09:15 提高难溶性药物溶解度和生物利用度的创新方法-Quadrant 2平台
王新峰,全球SME,赛默飞Patheon?制药服务部
09:45 口服制剂开发过程中如何克服难溶性,提高吸收性
吴伟,教授,复旦大学
10:30 茶歇
11:00 NDA阶段制剂研发的重点考量
王昕,制剂开发执行总监,诺诚健华
12:00 午餐
13:00 处方前研究在制剂成功研发中的重要性-案例研究
刘恒利,高级总监,凯信远达研发中心
13:45 晶体结构预测 (CSP) 在药物设计和可开发性评估中的应用
14:30 茶歇
15:00 创新药研发中的不同阶段的晶型研究内容,注意事项及法规要求
王志宣,CMC项目运营总监,赛诺菲
15:45 小组讨论:如何克服临床后期及商业化阶段制剂研发的各种挑战?
王志云,高级副总裁,再鼎医药
16:30 会议结束
论坛六 新药分析方法开发
7月28日(周四)
13:30 新药开发各个阶段的分析方法开发与验证策略
Qinglin Tang,质量副总裁,迪哲医药
14:15 液质联用技术在药物分析中的应用探讨
徐牛生,LC-MS应用经理,赛默飞
14:45 新药制剂产品开发中的分析研发与控制
15:30 茶歇
16:00 新药开发不同阶段的质量标准的制定/要求
陈东英,教授/研究员,中科院上海药物研究所
17:00 小组讨论:分析方法常用的问题及解决方案探讨
李敏,副总裁,浙江华海药业
17:45 会议结束
7月29日(周五)
08:30 新药研发过程中的杂质研究,分析方法与控制
吴四清,总经理,湖南醇健制药
09:30 新药研发中的标准品(包括杂质)的标化及要求
10:30 茶歇
11:00分析研究与产品CQA/CPP的确立
马元辉,CMC副总裁,海和药物
12:00 午餐
13:00 新药制剂研发中的辅料相容性与稳定性研究
沈建华,分析总监,苏州开拓药业
13:45 稳定性研究与评估
14:30 茶歇
15:00 新药开发过程中的OOS/OOE的调查与案例
15:45 小组讨论:分析团队在新药研发过程面临的挑战
16:30 会议结束
第13届仿制药国际峰会 | GIS2022
7月28-29日(周四~周五)
论坛七 仿制药原料药开发
7月28日(周四)
13:30 原料药生产工艺中杂质研究及控制
周伟澄,研究员,上海医药工业研究院
14:30 遗传毒性杂质含量测定方法的建立,鉴定及控制
15:30 茶歇
16:00 原料药的元素杂质研究和风险评估
17:00 小组讨论:原料药不同阶段的工艺杂质研究和控制探讨
朱伟,原料药事业部副总经理,华海药业
17:45 会议结束
7月29日(周五)
08:30 绿色化学在原料药开发中的应用
张绪穆,教授,南方科技大学
09:30 药物合成中连续流动化学的应用实例分析
10:30 茶歇
11:00 原料药合成工艺中技术转移关键因素的探讨
朱金林,董事、副总裁,浙江医药
12:00 午餐
13:00 原料药粒径对其片剂体外溶出行为的影响
13:45 连续结晶和晶型控制技术的开发与应用
14:30 茶歇
15:00 话题确定中
马建国,总裁,朗华制药
15:45 小组讨论:新的合成技术如何加速药物研发?
16:30 会议结束
论坛八 仿制药制剂工艺
7月28日(周四)
13:30 从FDA最近发布的几个复杂制剂PSG看FDA对BE和体外实验的最新要求
葛季声,副院长,华海药业
14:30 制剂逆向工程的重要性,策略和方法
张继稳,研究员,中国科学院上海药物研究所
15:30 茶歇
16:00 申报批和工艺验证批的法规要求和确保成功的关键因素
雷继锋,总经理,上海安必生制药
17:00 小组讨论:仿制药制剂处方工艺如何通过新技术、新方法去突破原研药技术壁垒
顾红梅,总裁助理/研究院副院长,正大天晴药业
17:45 会议结束
7月29日(周五)
08:30 固体制剂在工艺放大中常见的问题和解决方法
倪国军,产品开发负责人, 拜耳医药
09:15 以流池法评估软胶囊在人体的溶出行为
陆家祺,技术总监,深圳市锐拓仪器
09:45 QbD在仿制药研发中的应用和法规要求
10:30 茶歇
11:00 辅料在仿制药研发中的重要性,如何应对中美双方对辅料的不同要求
涂家生,教授,中国药科大学
12:00 午餐
13:00 体内外相关性的理论基础和溶出方法的开发
13:45 有体內相关性溶出方法在仿制药研发中的重要性和开发策略
14:30 茶歇
15:00 普通口服固体制剂餐前与餐后BE等效风险的评估及与药学的相关性
孙亚洲,首席科学家,长沙晶易
15:45 小组讨论:高壁垒仿制药如何选择与布局?
16:30 会议结束
论坛九 仿制药分析方法开发
7月28日(周四)
13:30 FDA对亚硝酸胺的最新控制要求
14:30 全球分析方法变更管理比较
15:30 茶歇
16:00 有稳定性指示性分析方法开发策略
胡昌勤, 化学药品检定首席专家, 中国食品药品检定研究院
17:00 小组讨论:分析方法法规要求趋势探讨
陈幸幸,副总裁,江苏长泰药业
17:45 会议结束
7月29日(周五)
08:30 Hold time 稳定性研究技巧
09:30 In-use 稳定性研究要求
陈洪,研发总经理,成都苑东生物
10:30 茶歇
11:00 美国药典杂质控制策略
操洪欣,高级总监,USP China
12:00 午餐
13:00 分析方法开发中色谱柱选择技巧
13:45 药物中基毒杂质的分析与控制
郑金琪,化学药品检验研究所所长,浙江省食品药品检验研究院
14:30 茶歇
15:00 怎么保证液体制剂Q1Q2Q3一致?
15:45 小组讨论:固体制剂常见的稳定性/杂质问题和解决方法
16:30 会议结束
论坛十 仿制药法规与监管要求
7月28日(周四)
13:30 仿制药首仿的legal strategies 对比
14:30 美国仿制药专利挑战和首仿案例分析
程秀秀,资深顾问,国内外药企
15:30 茶歇
16:00 晶型专利在仿制药立项和开发过程中的考量
17:00 小组讨论:中国专利链接制度的意义及其带来的机遇与挑战
徐波,副总经理,华海药业
17:45 会议结束
7月29日(周五)
08:30 仿制药在欧美日和亚太地区申报的法规要点
金顺,法规负责人,Sandoz
09:30 仿制药eCTD申报最新法规解读与应用
安稳定,副总经理,浙江海正药业
10:30 茶歇
11:00 话题确定中
梁毅,教授,中国药科大学
12:00 午餐
13:00 仿制药和505B(2)的申报途径的对比和选择
13:45 仿制药上市路径与注册策略
杨建红,主任药师,前CDE
14:30 茶歇
15:00 复杂仿制药相关法规进展 – FDA PSG指南分析
罗瑞昌,总经理,上海积成医药
15:45 小组讨论:新形势下对注册申报的分析,以及面临的问题
16:30 会议结束
论坛十一 仿制药BE设计
7月28日(周四)
13:30 话题确定中
张兰,药学部主任,首都医科大学宣武医院
14:30 BE试验样本量估算的考虑
15:30 茶歇
16:00 BE试验失败的常见原因解析
申屠建中,副主任,浙大一院药物临床试验机构
17:00 小组讨论:高BE试验通过率关键探讨
17:45 会议结束
7月29日(周五)
08:30 复杂制剂的BE试验设计-透皮
Jeff Wu,前研究员,强生
09:30 高风险药物的BE试验设计
10:30 茶歇
11:00 长半衰期药物的BE试验设计与常见问题
12:00 午餐
13:00 BE结论稳健性问题与模型化评价:原理与案例
郑青山,教授,上海中医药大学
13:45 影响生物等效性的关键制剂参数分析及评价方法
程泽能,教授,中南大学湘雅药学院
14:30 茶歇
15:00 复杂制剂的BE试验设计与常见问题-吸入制剂
丁黎,教授,中国药科大学
15:45 小组讨论:国内BE试验项目管理中常见问题及分析
16:30 会议结束
论坛十二 注射剂一致性评价
7月28日(周四)
13:30 注射剂生产场地变更及技术转移
尹放东, 技术与制造科学总监,礼来
14:15 注射剂包装密封性与相容性研究实践与探讨(30m)
侯峰,副总经理,广州法尔麦兰药物技术有限公司
14:45 原料药质量对注射剂一致性的影响
15:30 茶歇
16:00 注射剂辅料对产品一致性的影响
许文东,总工程师,广州白云山汉方现代药业
17:00 小组讨论:注射剂一致性评价中的药学关键点
霍秀敏,主任药师,高级审评员,前CDE
17:45 会议结束
7月29日(周五)
08:30 注射剂一致性评价从研发到生产到注册申报过程
宋庆国,技术发展高级总监,健进制药
09:30 脂质体类注射剂一致性技术要点
10:30 茶歇
11:00 多肽注射剂体一致性评价技术要点
12:00 午餐
13:00 冻干制剂一致性评价的考虑
13:45 复杂制剂一致性评价分析方法开发和使用
14:30 茶歇
15:00 一致性评价中包材相容性研究要点
张芳芳,质量科研室主任,上海市食品药品包装材料测试所
15:45 小组讨论:注射剂一致性评价下的竞争策略讨论
胡和平, 研究院副院长, 四川汇宇制药
16:30 会议结束
了解CIS2021最新会议议程

联系人:Luke Xia
电话:021-60538962
手机:133-0185-8344
邮箱:luke.xia@bestmediaworld.com
官网:https://www.bagevent.com/event/8019353
媒体合作:Linda Liu
微信:15102165303